GMP(GOOD MANUFACTURING PRACTICE)
良好生產規范:世界衛生組織將GMP定義為指導食物、藥品、醫療產品生產和質量管理的法規。GMP要求制藥、食品等生產企業應具備良好的生產設備,合理的生產過程,完善的質量管理和嚴格的檢測系統,確保產品質量(包括食品安全衛生)符合法規要求。對此標準的監督與實施是由FDA來執行。
GLP(Good Laboratory Practice)
藥物非臨床研究質量管理規范:藥物的非臨床研究是指非人體研究,亦稱為臨床前研究,用于評價藥物的安全性,在實驗室條件下,通過動物實驗進行非臨床(非人體)的各種毒性實驗,包括單次給藥的毒性試驗、反復給藥的毒性試驗、生殖毒性試驗、致突變試驗、致癌試驗、各種刺激性試驗、依賴性試驗以及與藥品安全性的評價有關的其他毒性試驗。我國的《藥品非臨床研究質量管理規范》于1999年發布并于1999年11月1日起施行。對此標準的監督與實施是由FDA來執行。
GCP(Good Clinical Practice)
藥品臨床試驗管理規范:規范藥品臨床試驗全過程的標準規定,其目的在于保證臨床試驗過程的規范,結果科學可靠,保護受試者的權益并保障其安全。GCP不但適用于承擔各期(I--IV期)臨床試驗的人員(包括醫院管理人員、倫理委員會成員、各研究領域專家、教授、醫師、藥師、人員及實驗室技術人員),同時也適用于藥品監督管理人員、制藥企業臨床研究員及相關人員。對此標準的監督與實施是由FDA來執行。
FDA/USP/GxP關系梳理
USP是產品與檢測方法的標準。FDA對藥品和營養補充劑的管理引用部分USP標準。但不是所有USP標準都是被法律化的。FDA負責監督和實施GxP的執行。
GMP、GLP和GCP的區別
制藥業重要規范統稱藥品GxP,包括常見的GMP、GLP和GCP-以下分析三者區別:
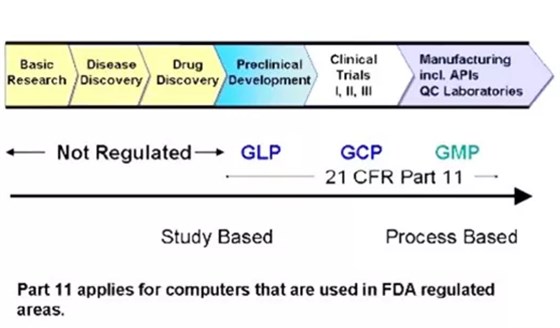
在GMP、GLP和GCP的規范下,藥品的質量可控性、安全性和有效性由各項試驗得到充分證據,注冊申報通過審查,藥品被批準上市。目的達到,交集完成了使命。非臨床研究不再,GLP就結束了;如果有上市后臨床試驗,GCP必不可少;只要產品不撤市,生產繼續,GMP就無止境。
文章來源:公眾號 普利賽斯 如有問題,聯系本站刪除!

 智慧電子秤 帶攝像頭 食堂收貨分揀
智慧電子秤 帶攝像頭 食堂收貨分揀 4G物聯網智能電子秤
4G物聯網智能電子秤 不干膠打印電子秤
不干膠打印電子秤 智能倉儲管理稱重電子秤
智能倉儲管理稱重電子秤